每日經濟新聞 2020-10-22 15:33:52
每經記者|金喆 每經編輯|梁梟

丁香園Insight數據庫援引國家藥品監督管理局藥品審評中心數據顯示,9月16日~10月15日,中心共承辦952例申報進度,其中受理化藥申請734項,抗體類80項,多肽35項,中藥申請32項,非抗體類蛋白29項,疫苗類17項,血液制品相關12項,輔料3項,細胞治療2項,微生物相關1項。
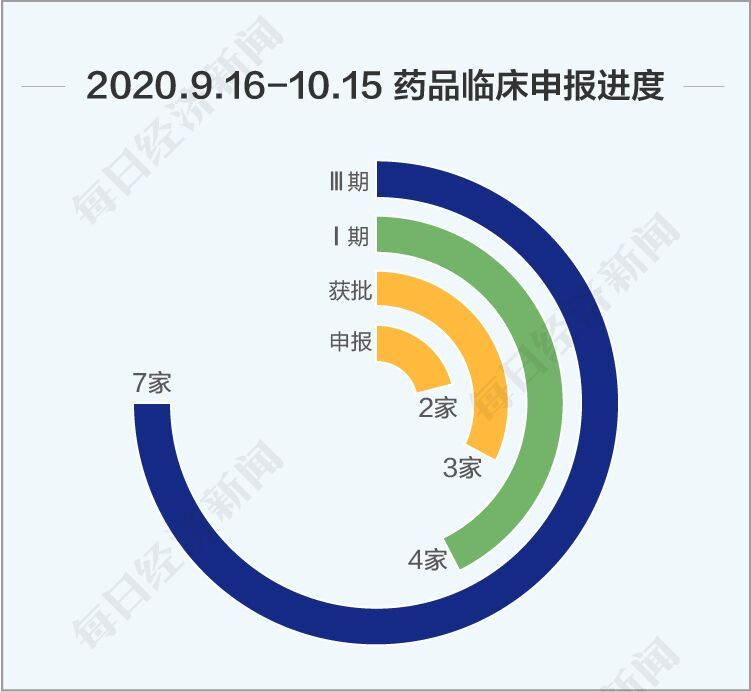
回顧9月16日以來的一個月,一類新藥申報數量再創新高,本階段一類新藥臨床申請數量達到55個,上市申請6個,抗腫瘤藥物仍是主要研發方向。《每日經濟新聞》記者認為,本階段新藥研發的亮點如下:
一、信達生物生物類似藥利妥昔單抗注射液獲批上市;
二、康方生物PD-1/CTLA-4雙抗AK104納入突破性療法程序;
創新藥研發勢頭猛烈,投資市場也一片紅火。本階段,再鼎醫藥在香港上市,成為首個在香港二次上市的醫藥企業,目前市值超過500億港元。此外,高瓴資本投資的嘉和生物也在10月7日在港交所掛牌上市,此前認購倍數達到1247倍。
(1)信達生物生物類似藥利妥昔單抗注射液獲批上市,為國內第二家
每經點評:國產第二家,利妥昔又要降價了嗎?
利妥昔單抗,是目前臨床使用較廣泛的單克隆抗體藥物,原研藥美羅華1997年11月在美國上市。2000年4月,美羅華在中國上市,并在2017年進入國家醫保目錄,500mg/50ml/瓶的規格降到8298元,100mg/10ml/瓶規格降到2418元。
《每日經濟新聞》記者注意到,目前美羅華在中國獲批的適應癥如下:慢性淋巴細胞白血病/小淋巴細胞淋巴瘤、濾泡性淋巴瘤、CD20陽性彌漫性大B細胞淋巴瘤、CD20陽性晚期/轉移性濾泡性淋巴瘤、濾泡性中央型淋巴瘤。
2019年2月22日,復宏漢霖的利妥昔單抗注射液(商品名為漢利康)獲批上市,成為國內獲批的首個生物類似藥,目前獲批的適應癥包括:慢性淋巴細胞白血病/小淋巴細胞淋巴瘤、濾泡性淋巴瘤、CD20陽性彌漫性大B細胞淋巴瘤、CD20陽性晚期/轉移性濾泡性淋巴瘤、濾泡性中央型淋巴瘤。
漢利康于2019年在多地被納入醫保,Insight數據庫顯示,其目前最低中標價為1398.00元(100mg/10ml/瓶)。
信達生物本次獲批上市的利妥昔單抗達伯華共包含3個適應癥,分別是彌漫性大B細胞淋巴瘤、慢性淋巴細胞白血病/小淋巴細胞淋巴瘤和濾泡性淋巴瘤。
也就是說,達伯華目前適應癥比漢利康少2個。如果是價格戰,漢利康的價格已經比美羅華便宜42%,失去首發優勢的信達生物又要如何攪局呢?
信達生物內部人士接受媒體采訪時說:“我們相信目前市場規模足夠大且在不斷增長,也存在巨大的未被滿足的臨床需求。我們希望我們能夠為需要的老百姓提供可負擔、高質量的利妥昔單抗。”
與其他熱門藥物一樣,國內還有多家企業在利妥昔的研發路上。Insight數據庫顯示,海正藥業、正大天晴、嘉和生物、華蘭生物、山東新時代、上海生物制品研究所、喜康(武漢)生物醫藥有限公司等7家企業的利妥昔單抗處于三期臨床,還有4家公司處于一期臨床、3家公司獲批臨床、2家公司申報臨床申請。
復宏漢霖的漢利康上市給原研藥帶來的壓力已經顯現。我們可以預見,未來利妥昔的競爭將相當激烈。不過,達伯華獲批上市的消息還是在二級市場有所反應。10月12日,信達生物漲幅超過10%,10月15日盤中股價觸及上市以來新高69.75港元/股。
(2)康方生物PD-1/CTLA-4雙抗AK104納入突破性療法程序
每經點評:康方生物王牌產品研發又進一步,國內雙抗藥物成色如何?
10月12日,康方生物公布,其核心自主研發的、全球首創的新型腫瘤免疫治療雙特異性抗體新藥PD-1╱CTLA-4(研發代號:AK104),獲國家藥品監督管理局藥品審評中心審核同意,納入“突破性治療藥物品種”。
近年來,雙抗巨大的治療潛力,正促使雙抗藥物成為新藥研發投資的“新寵”。據弗若斯特沙利文預測,到2025年,雙抗研發管線的增長速度可以達到常規單抗藥物的3倍,且隨著全新雙抗進入市場,同時已上市雙抗獲批更多適應癥,市場規模將達到80億美元(約合人民幣560億元)。
而在國內,雙抗藥物的研發屬于稀缺品種,而且全部集中在腫瘤治療領域。信達生物新藥生物與轉化醫學副總裁徐偉博士此前對科技日報記者談到,腫瘤治療已從最初的化療、靶向治療過渡到了免疫治療,極大提高了病人的生存率。
在這條競爭白熱化的賽道上,平臺與靶點選擇的適配性,是當下決定雙抗項目能否成功的關鍵因素。因為一個適應雙抗分子的技術平臺,對分子的成藥性、錯配率和穩定性有重要影響。《每日經濟新聞》記者注意到,目前國內雙抗藥物研發主要圍繞PD-1、HER2的靶點。
根據丁香園Insight數據庫,國內在研雙抗藥物中,PD-1/PD-L1是主流靶點,不計引進項目就有14個PD-1/PD-L1國產雙抗品種在研;其次熱門的雙抗靶點還包括CD3、CTLA4、HER2等。
AK104之所以受市場看好,主要有兩方面原因:一是全球首個進入臨床試驗的PD-1/CTLA-4雙特異抗體,二是覆蓋多癌種。
Insight數據庫顯示,該藥已在CDE登記并啟動6項臨床,在ClinicalTrails.gov登記11項臨床,單藥或聯合用藥治療多種實體瘤。其適應癥布局包括肝細胞癌、鼻咽癌、非小細胞肺癌、胃癌、三陰乳腺癌等多個癌種,國內最高處于二期臨床。
目前,國內同靶點雙抗僅齊魯QL1706,于2020年3月啟動一期臨床。另外,已進入臨床階段的靶向CTLA-4雙抗還包括康寧杰瑞KN046(PD-L1/CTLA-4)和四川百利SI-B003(PD-1或L1/CTLA-4),分別處于三期臨床和二期臨床。
(1)本階段首次注冊上市的品種有11個,在注冊品種36個。按類別劃分(合并不同規格統一品種),化藥仿制藥32個,生物制品類似藥1個,非原研/類似藥生物制品1個。
本階段申報的項目中,化藥仿制藥272項,化藥新藥/原研藥271項,生物制品新藥/原研藥104項,化藥改良型新藥13項,非原研/類似藥生物制品10項,生物制品改良型新藥6項,生物制品類似藥6項,暫時不明29項。
按成分治療領域排名,前五位是:抗腫瘤藥物(151項),抗感染藥物(109項),內分泌系統和代謝藥物(81項),心血管系統藥物(74項),神經系統藥物(74項)。
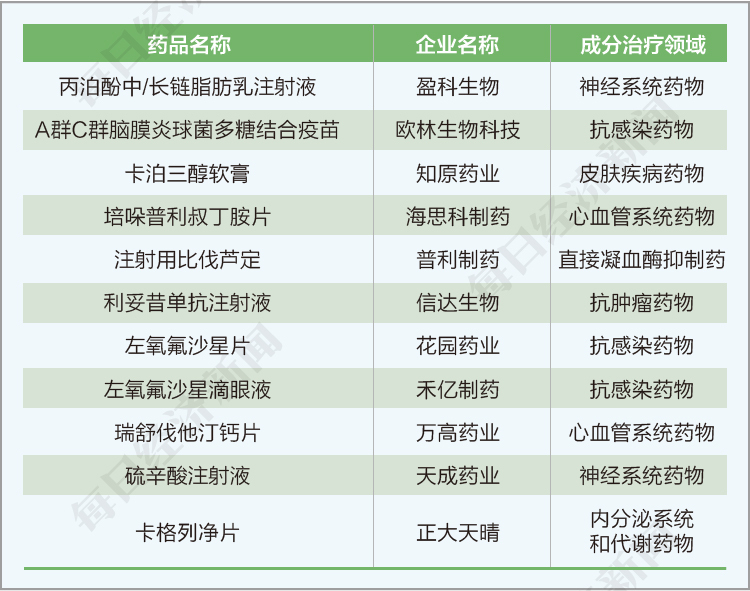
(2)本階段申報的項目中,化藥仿制藥272項,化藥新藥/原研藥271項,生物制品新藥/原研藥104項,化藥改良型新藥13項,非原研/類似藥生物制品10項,生物制品改良型新藥6項,生物制品類似藥6項,暫時不明29項。
按成分治療領域排名,前五位分別是:抗腫瘤藥物(151項),抗感染藥物(109項),內分泌系統和代謝藥物(81項),心血管系統藥物(74項),神經系統藥物(74項)。
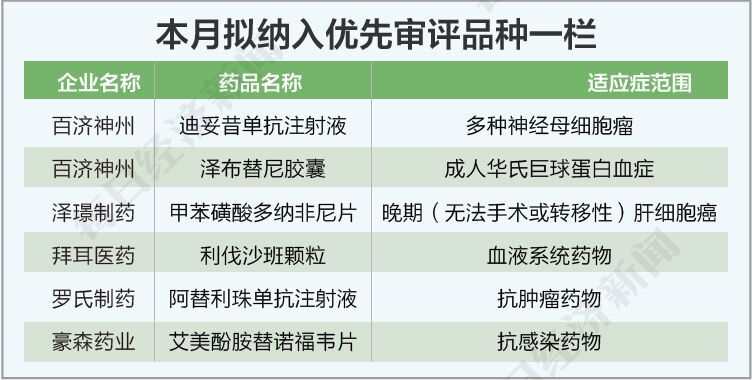
本月納入優先審評的品種有6個。
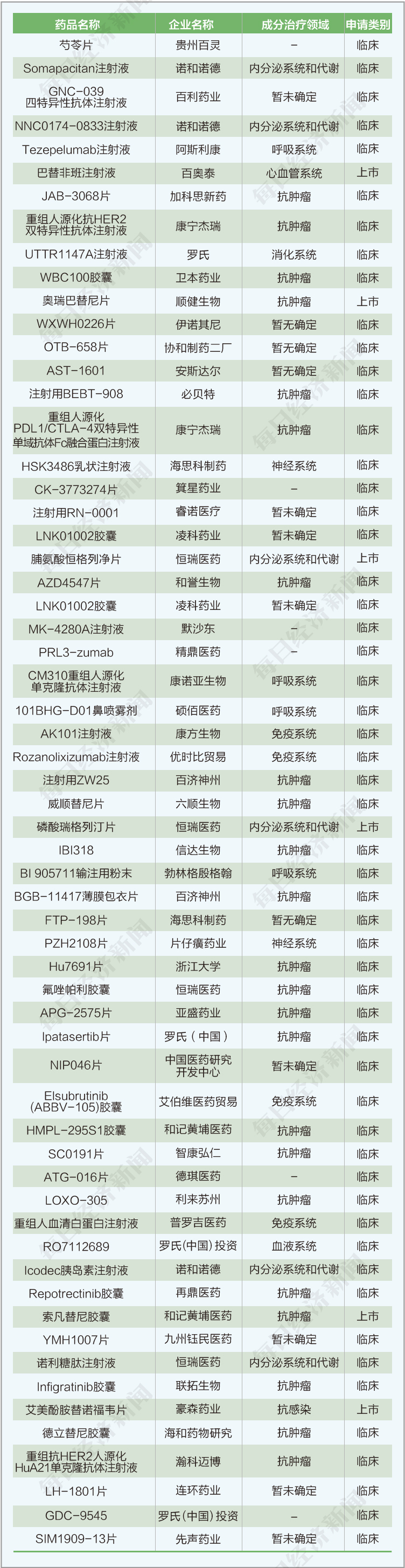
(3)本期共有一類注冊新藥臨床申請55個,上市申請6個。
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
